Kultiveret kød er dyrt, men omkostningerne falder. Den største hindring? Vækstmedier, som kan koste hundrede pund per liter. For at konkurrere med traditionelt kød skal priserne falde til £1 per liter eller mindre. Tre strategier driver denne ændring:
- Cell Line Engineering: Justering af dyreceller for at reducere næringsbehov og vokse effektivt.
- Media Optimisation: Erstatte dyre farmaceutiske ingredienser med billigere fødevaregrad alternativer.
- Bioreactor Improvements: Skalering af produktionen med større, mere effektive systemer.
Hver tilgang tackler en unik udfordring, men deres samlede fremskridt er nøglen til at gøre kultiveret kød overkommeligt. Målet? At bringe priserne tættere på konventionelt kød, så det bliver tilgængeligt for alle.
Engineering Cell Lines for Cultured Meat and Sustainable Cellular Agriculture #culturedmeat
1.Cell Line Engineering
Cell line engineering tilbyder en smart måde at reducere næringsomkostningerne ved at justere dyreceller til at producere deres egne vækstfaktorer. I stedet for konstant at tilsætte dyre vækstfaktorer til kulturmediet, gør forskere det muligt for celler at skabe disse næringsstoffer selv gennem autokrin signalering.
I 2024 lykkedes det Andrew J. Stout og hans team ved Tufts University at konstruere bovine muskelceller til at producere deres egen FGF2 [4][2]. Kevin Kayser, Chief Scientific Officer hos Upside Foods, opsummerede tilgangen perfekt:
"Lad os bygge en proces og derefter vælge en cellelinje, der gør det, vi ønsker, at den skal gøre. Det vil kræve meget mere forarbejde, men i sidste ende vil det oversætte til bedre omkostninger" [1].
Potential for omkostningsreduktion
Rekombinante proteiner og vækstfaktorer er de største omkostningsdrivere i produktionsprocessen [3]. Ved at konstruere celler til at generere deres egne vækstfaktorer kan virksomheder eliminere behovet for dyre eksterne kosttilskud - noget der ellers ville kræve en næsten 99% omkostningsreduktion for at gøre dyrket kød kommercielt levedygtigt [5]. Derudover muliggør modificering af celler til at vokse i suspension, i stedet for at kræve en overflade, brugen af massive omrørte bioreaktorer (nogle der overstiger 20.000 liter), hvilket betydeligt øger produktionseffektiviteten [2].
Implementeringstidsramme
Denne tilgang er ikke uden sine udfordringer.At udvikle og karakterisere en ny cellelinje tager typisk 6 til 18 måneder [3], hvilket står i skarp kontrast til den meget kortere produktionscyklus på blot 2–8 uger, fra cellebank til høst [3]. I 2023 var næsten halvdelen af dyrkede kødvirksomheder allerede i gang med at udforske genetisk engineering til enten forsknings- eller kommercielle formål [3], hvilket positionerer industrien til yderligere at forfine omkostningsbesparende strategier.
Tekniske Udfordringer
Der er stadig forhindringer, der skal overvindes. At opretholde genomisk stabilitet og opnå umuliggørelse for ubegribelig celleproliferation - samtidig med at sikre, at cellerne stadig kan differentiere korrekt - forbliver en svær nød at knække [4][3]. Derudover er tilgængeligheden af cellelinjer med de rette egenskaber stadig begrænset [4].Disse udfordringer fremhæver kompleksiteten ved cellelinjeengineering, men de potentielle belønninger gør det til en lovende vej for at reducere omkostningerne. Næste skridt er, at vi vil udforske strategier for medieoptimering.
2. Optimering af medier og vækstfaktorer
At reducere omkostningerne ved vækstmedier er en nøglestrategi for at gøre dyrket kød mere overkommeligt. Lige nu er cellekulturmedier den største udgift i produktion af dyrket kød [5][3]. Ved at skære ned på disse omkostninger er der en kæmpe mulighed for at bringe priserne tættere på, hvad forbrugerne er villige til at betale.
For at nå en målpris på £8 per kilogram skal medieomkostningerne falde med over 99,9% fra deres nuværende farmaceutiske niveauer. Vækstfaktorer alene skal begrænses til kun £0,80 per kilogram [3][5].Som Good Food Institute forklarer:
"Den største udfordring, som den dyrkede kødindustri står overfor, er ikke blot at undgå animalske komponenter i cellekulturmediet, men snarere at finde ud af, hvordan man gør det økonomisk overkommeligt og hvordan man optimerer overkommelige formuleringer for maksimal produktivitet" [3].
Omkostningsreduktion Potentiale
En af de primære tilgange til at skære omkostninger er at erstatte dyre farmaceutiske ingredienser med billigere, fødevarekvalitetsalternativer. For eksempel er albumin, som udgør 96,6% af behovet for rekombinant protein, målrettet med plantebaserede substitutter som raps og kikærter. Ligeledes bytter virksomheder individuelle aminosyrer ud med mere overkommelige plantehydrolysater [5][3][1].
Der gøres allerede fremskridt.I august 2024 introducerede Believer Meats et animalsk komponentfrit medium, der kun koster £0,50 per liter [6]. Ved at bruge kontinuerlige fremstillingsmetoder som tangential flow filtration viste deres analyse, at dyrket kylling kunne produceres til £5 per pund i en 50.000-liters facilitet - hvilket gør det konkurrencedygtigt med priserne på økologisk kylling [6]. Tilsvarende viste Mosa Meat, i partnerskab med Nutreco, at det at skifte fra farmaceutisk kvalitet til fødevarekvalitet aminosyrer alene kunne reducere omkostningerne med en faktor på 100, alt sammen uden at gå på kompromis med celleudbyttet [1].
Implementeringstidsramme
Sammenlignet med cellelinje engineering kan medieoptimering levere resultater meget hurtigere.Mens udviklingen af nye cellelinjer kan tage 6 til 18 måneder [3], udnytter reformulering af medier ofte eksisterende fødevaregodkendte forsyningskæder, hvilket fremskynder processen. Susanne Wiegel, leder af Alternative Protein Programme hos Nutreco, opsummerer det godt:
"At fodre celler er ikke så forskelligt fra at fodre dyr. Størstedelen af næringsstofferne leveres gennem landbrugsafgrøder" [1].
Tekniske Udfordringer
På trods af løftet om omkostningsbesparelser, medfører brugen af fødevaregodkendte ingredienser udfordringer. Disse ingredienser kan introducere urenheder, batch-inkonsistenser og potentielle påvirkninger på celleydelse og produktkvalitet [5][2]. Derudover er det ingen lille bedrift at skalere produktionen op for at imødekomme efterspørgslen.At fange blot 1% af det globale kødmarked ville kræve millioner af kilogram rekombinant albumin - langt over de nuværende produktionsniveauer for mange industrielle enzymer [5].
Næste skridt er at undersøge, hvordan forbedringer i bioreaktorer og processer kan yderligere reducere omkostningerne.
sbb-itb-c323ed3
3. Forbedringer af bioreaktorer og processer
Efter at have forfinet cellelinjeengineering og optimeret medier, ligger det næste skridt i at reducere omkostningerne for kultiveret kød i at forbedre bioreaktorer og produktionsprocesser. Mens cellelinjer og medier fokuserer på den biologiske side, spiller de fysiske systemer - bioreaktorer og produktionsarbejdsgange - en afgørende rolle i at gøre kultiveret kød mere overkommeligt. Som Good Food Institute passende udtaler:
"Bioprocessdesign er nøglen til at låse op for storskala produktion af kultiveret kød" [3].
lige nu er de fleste bioreaktorer, der bruges i produktionen af kultiveret kød, tilpasset fra medicinalindustrien. Disse systemer er designet til højværdi, lavvolumen output, hvilket ikke er ideelt for de omkostningseffektive, højvolumen krav til fødevareproduktion [3]. For at konkurrere med traditionelt kød har industrien brug for specialbyggede bioreaktorer, der er designet specifikt til storskala, økonomisk produktion. Her kan procesoptimeringer hjælpe med at drive omkostningerne yderligere ned.
Omkostningsreduktion Potentiale
En af de mest lovende måder at skære omkostningerne på er ved at gå fra farmaceutisk kvalitet til fødevarekvalitet produktionsstandarder. I modsætning til farmaceutiske anvendelser skal kultiveret kød kun opfylde fødevaresikkerhedsstandarder, som er mindre strenge. Dette skift kan betydeligt reducere driftsomkostningerne [3].
Proces effektivitet er en anden kritisk faktor.Teknikker som genbrug af vækstmedier, omdannelse af affaldsstrømme og implementering af automatisering kan hjælpe med at minimere brugen af dyre input [3]. For eksempel annoncerede Upside Foods i september 2023 sine planer for en kommerciel facilitet nær Chicago. Denne facilitet har til formål at producere 13.000 ton kultiveret kød årligt ved hjælp af bioreaktorer så store som 100.000 liter [1]. Kevin Kayser, virksomhedens Chief Scientific Officer, fremhævede vigtigheden af at fokusere på råmaterialeinput:
"En af grundene til, at jeg blev ansat, var råmaterialeinput... Da jeg først startede, var det øverst på listen" [1].
Skalerbarhed
At opskalere bioreaktorer er essentielt for at opnå prisparitet med konventionelt kød. I øjeblikket bruger pilotanlæg bioreaktorer, der spænder fra 100 til 1.000 liter.Men techno-økonomiske analyser antyder, at opnåelse af konkurrencedygtige priser vil kræve bioreaktorer med volumener på 20.000 liter eller mere - muligvis endda 100.000 liter [3][1][2]. Ved udgangen af 2024 havde mindst ét firma med succes skaleret op til bioreaktorer med en kapacitet på 15.000 liter [3].
Industrien bevæger sig gennem distinkte faser: fra bænkskala forskning (bioreaktorer under 10 liter), til pilot-skala test, og til sidst til industriel produktion. Hver fase kræver ikke kun større udstyr, men også innovationer inden for blanding, iltforsyning og overvågningssystemer [3].
Tekniske Udfordringer
At skalere op bioreaktorer er ikke uden sine udfordringer.Større bioreaktorer medfører unikke tekniske udfordringer, såsom håndtering af skærkræfter under blanding og iltning, som kan skade sarte celler [3]. Iltoverførsel bliver stadig mere kompleks, efterhånden som bioreaktormængderne vokser, og opretholdelse af sterilitet i storskala, fødevarekvalitetsanlæg er kritisk - enhver kontaminering kan resultere i betydelige produktionstab [3].
Som Kevin Kayser bemærkede, udforsker industrien nyt terræn:
"Når du begynder at tale om 100.000 L eller mere, ved jeg ikke, om det vil kræve nogen ændring i mediet. Vi er ikke nået til det niveau" [1].
I modsætning til medieoptimering, som kan udnytte eksisterende fødevareforsyningskæder, kræver skalering af bioreaktorer løsning af helt nye ingeniørproblemer, især ved disse hidtil usete størrelser [3].
Implementeringstidsramme
Opbygning af industrielle faciliteter i stor skala er en tidskrævende og kapitaltung proces. Mens udviklingen af en ny cellelinje kan tage 6 til 18 måneder [3], tager konstruktion og idriftsættelse af en produktionsfacilitet i fuld skala år med planlægning og betydelige investeringer [3]. Nye teknologier hjælper dog med at fremskynde processen. For eksempel har automatiserede og cloud-baserede systemer vist sig at reducere udviklingscyklusser med 25% og forbedre succesraterne for opskalering med 30% [7]. Chris Williams, CEO for Culture Biosciences, forklarede:
"Overgangen til cloud-baseret, modulær bioprocessering accelererer i biotek- og biopharma-sektorerne... Det tilbyder en fleksibel, omkostningseffektiv løsning for teams, der har brug for hurtigere udviklingscyklusser og skalerbarhed" [7].
Selve dyrkningsprocessen - fra cellebank til høst - tager typisk 2 til 8 uger, afhængigt af hvilken type kød der produceres [3]. Fremskridt inden for bioprocessering vil være afgørende for at gøre dyrket kød til en konkurrencedygtig mulighed på markedet.
Sammenligning af de tre tilgange
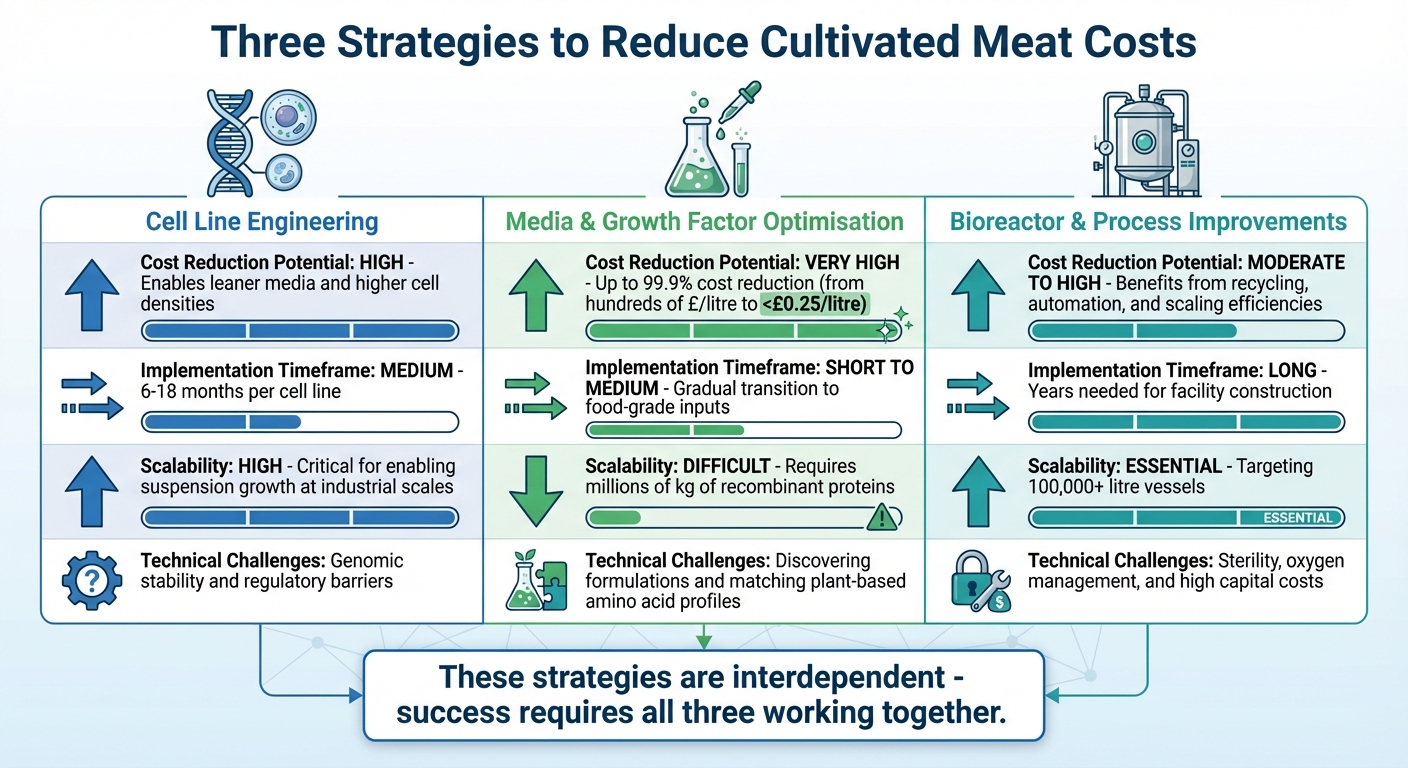
Sammenligning af tre strategier for at reducere omkostningerne ved produktion af dyrket kød
Når man ser på cellelinjeengineering, medieoptimering og bioreaktorfremskridt side om side, afsløres det, hvor sammenkoblede disse strategier er. Hver bringer sine egne styrker og udfordringer til bordet, men sammen skaber de en vej til at reducere omkostningerne ved produktion af dyrket kød.
Her er en oversigt over, hvordan disse tilgange klarer sig på tværs af fire nøglekriterier:
| Kriterium | Cell Line Engineering | Medie &og Vækstfaktor Optimering | Bioreaktor &og Procesforbedringer |
|---|---|---|---|
| Potentiale for Omkostningsreduktion | Højt – muliggør slankere medier og højere celletætheder | Meget Højt – kan reducere omkostningerne med op til 99.9% fra nuværende biomedicinske priser | Moderat til høj – fordele ved genanvendelse, automatisering og skaleringseffektivitet |
| Implementeringstidspunkt | Medium – tager normalt 6–18 måneder pr. cellelinje | Kort til medium – involverer gradvis overgang til fødevarekvalitetsinput | Lang – år kræves til anlægsbyggeri og idriftsættelse |
| Skalerbarhed | Høj – kritisk for at muliggøre suspensionsvækst i industrielle skalaer | Svært – kræver produktion af millioner af kilogram rekombinante proteiner | Væsentligt – sigter mod 100.000-liters+ beholdere til storskala produktion |
| Tekniske udfordringer | Genomisk stabilitet og reguleringsbarrierer | Opdagelse af formuleringer og matchende plantebaserede aminosyreprofiler | Sikring af sterilitetsforhold, iltstyring og håndtering af høje kapitalomkostninger |
Hver strategi spiller en særskilt rolle i at tackle omkostningsudfordringerne ved kultiveret kød.
Medieoptimering skiller sig ud for sit umiddelbare potentiale til at reducere omkostningerne. Priserne kunne falde fra hundrede pund per liter til mindre end £0,25 per liter [3]. Dog er det en betydelig hindring at skalere denne tilgang for at imødekomme industrielle krav.
Cell line engineering, derimod, lægger grunden til succes. Ved at muliggøre suspensionsvækst og reducere mediekravene understøtter det både medieoptimering og bioreaktorskala [3]. Uden pålidelige cellelinjer ville fremskridt på de andre områder stagnere.
Forbedringer af bioreaktorer er et langsigtet spil. At udvikle og idriftsætte faciliteter, der kan håndtere 100.000-liters beholdere, er en skræmmende opgave, men det er essentielt for at skalere op til produktion på kommercielt niveau [3].De ingeniørmæssige udfordringer her, især omkring sterilitets- og iltoverførsel, forbliver stort set uopdaget territorium på denne skala.
Virkeligheden er, at ingen enkelt tilgang kan bære vægten af omkostningsreduktion alene. Disse strategier er dybt indbyrdes afhængige. For eksempel har overkommelige medier kun værdi, hvis bioreaktorer kan operere i høje volumener, og store bioreaktorer giver kun mening, hvis de medier, de bruger, er omkostningseffektive [3]. Sammen skaber disse bestræbelser en sammenhængende ramme, der er kritisk for at gøre kommercielt skala dyrket kød til en realitet.
Konklusion
Cell line engineering spiller en nøgle rolle i at drive succesen af både medieforskning og bioreaktor fremskridt. Ved at udvikle celler, der vokser hurtigere, når højere tæthed og præsterer godt i magrere medier, reducerer det betydeligt omkostningerne knyttet til næringsstoffer og bioreaktorkapacitet.Dette gør det til en hjørnesten i at reducere produktionsomkostninger.
Medieraffinering tilbyder øjeblikkelige besparelser, med potentiale til at reducere medieomkostninger med op til 99,9%, hvilket bringer priserne på farmaceutisk kvalitet ned til mindre end £0,20 per liter [3]. Dog afhænger disse besparelser af cellelinjer, der kan trives på sådanne omkostningseffektive medier. Samtidig baner avancerede bioreaktordesigns vejen for storskala produktion, men deres økonomiske levedygtighed afhænger af at parre dem med overkommelige medier og robuste, konstruerede cellelinjer.
Tidslinjen for at opnå prisparitet med premium konventionelt kød i Storbritannien vil blive formet af, hvor hurtigt disse tre strategier - celleengineering, medieudvikling og bioreaktorskala - skrider frem sammen. Fremskridt på disse områder vil danne grundlaget for at gøre kultiveret kød mere tilgængeligt.
For britiske forbrugere vil den brede tilgængelighed også afhænge af regulatorisk godkendelse, som stadig er under gennemgang i slutningen af 2025 [3], og oprettelsen af storskala produktionsfaciliteter. Virksomheder planlægger allerede bioreaktorer på 100.000 liter og sigter mod faciliteter, der kan producere op til 13.000 ton årligt [1], hvilket signalerer, at den nødvendige infrastruktur er ved at tage form.
Rejsen mod overkommelig kultiveret kød vil afhænge af den problemfrie integration af disse tre strategier. Et produktionsøkosystem, der kombinerer konstruerede celler, lavpris medier og bioreaktorer i industriel skala, vil bestemme, hvornår kultiveret kød bevæger sig fra niche dining oplevelser til dagligvarebutikker.
Ofte stillede spørgsmål
Hvordan hjælper cellelinjeteknologi med at sænke omkostningerne ved dyrket kød?
Fremskridt inden for cellelinjeteknologi har sænket omkostningerne ved produktion af dyrket kød ved at forbedre ydeevnen af de celler, der anvendes i processen. Disse specielt designede cellelinjer vokser hurtigt, kan trives i tætte miljøer og modstå hårde forhold som lave iltniveauer og mekanisk stress. Dette betyder mindre afhængighed af dyre vækstmedier og mere effektiv, højtydende produktion i bioreaktorer.
Ved at reducere råvare- og behandlingsomkostninger hjælper cellelinjeteknologi med at gøre dyrket kød mere tilgængeligt. Denne fremgang er et skridt mod at etablere det som et praktisk alternativ til traditionelt kød.
Hvad er de største udfordringer ved brug af fødevarekvalitetsmedier til produktion af dyrket kød?
Overgangen til fødevarekvalitetsmedier til produktion af dyrket kød medfører nogle svære udfordringer.En af de største forhindringer er omkostningerne. Lige nu udgør vækstfaktor-rige medier - som er essentielle for cellevækst - mere end halvdelen af produktionsomkostningerne. For at reducere omkostningerne skal producenterne skifte fra dyre farmaceutiske ingredienser til billigere, fødevarekompatible alternativer. Men her er udfordringen: udviklingen af disse overkommelige muligheder, hvad enten det er gennem præcisionsfermentering eller plantebaserede metoder, er stadig i sine tidlige faser og kræver en stor investering.
Et andet stort problem ligger i at opfylde strenge fødevaresikkerhedsstandarder. Fødevaregradede medier skal produceres under sterile forhold, fri for kontaminanter, og opfylde EU's fødevareforskrifter. Dette tilføjer lag af kompleksitet til forsyningskæder og kvalitetskontrolprocesser. Oven i det skaber fjernelse af serum - som almindeligvis anvendes i forskningsgradede medier - nye affaldshåndteringsudfordringer.Uden serum, der fungerer som en naturlig buffer, bliver ophobning af biprodukter et problem, der kræver avancerede genanvendelses- eller fjernelsessystemer.
Der er også spørgsmålet om celleadaptation. Mange cellelinjer, der oprindeligt blev udviklet til serumbaserede miljøer, har svært ved at vokse i kemisk definerede, dyrefri medier. Dette kan føre til langsommere vækst eller svagere celler, hvilket ofte kræver genetiske justeringer af cellelinjerne eller oprettelse af specialiserede kosttilskud. At tackle disse udfordringer er afgørende for at skalere produktionen af kultiveret kød og gøre det mere overkommeligt og tilgængeligt for forbrugerne. Hvis du er nysgerrig efter at lære mere om dette fascinerende felt, tilbyder
Hvordan hjælper storskala bioreaktorer med at gøre kultiveret kød mere overkommeligt?
Storskala bioreaktorer, især dem med kapaciteter, der overstiger 20.000 liter, spiller en nøglerolle i at sænke produktionsomkostningerne for kultiveret kød.Disse systemer muliggør produktionen af store mængder kød, hvilket hjælper med at sprede udgifter som udstyr, arbejdskraft og vækstmedier over en større produktion. Denne tilgang hjælper med at opnå stordriftsfordele, hvilket bringer kultiveret kød tættere på at matche prisen på traditionelt kød.
Med dette produktionsniveau kan producenterne dramatisk reducere omkostningerne pr. kilogram, hvilket baner vejen for, at kultiveret kød kan blive en mere overkommelig og levedygtig mulighed for forbrugerne.












